- Mwandishi Alex Aldridge [email protected].
- Public 2023-12-17 13:51.
- Mwisho uliobadilishwa 2025-06-01 07:38.
Tofauti kuu kati ya monoksidi ya nitrojeni na pentoksidi ya nitrojeni ni kwamba monoksidi ya nitrojeni ni gesi isiyo na rangi huku pentoksidi ya dioksidi ni thabiti nyeupe.
Monoksidi ya nitrojeni na pentoksidi ya nitrojeni ni misombo ya kemikali iliyo na nitrojeni na oksijeni. Hizi ni oksidi za nitrojeni. Hata hivyo, zina sifa tofauti za kemikali na kimwili.
Nitrogen Monoxide ni nini?
Monoksidi ya nitrojeni ni kiwanja isokaboni chenye fomula ya kemikali NO. Tunaiita nitriki oksidi kwa kuwa ni oksidi ya nitrojeni. Kwa kweli ni radical huria kwa sababu ina elektroni ambayo haijaunganishwa. Zaidi ya hayo, ni molekuli ya diatomia ya heteronuclear.
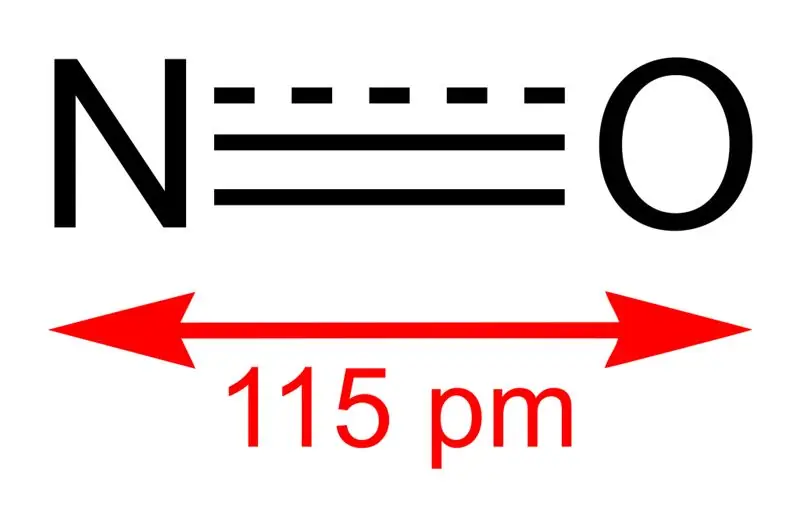
Mchoro 01: Muundo wa Monoksidi ya Nitrojeni na Urefu wa Muunganisho kati ya N na O
Uzito wa molar ya kiwanja hiki ni 30 g/mol. Inatokea kama gesi isiyo na rangi. Zaidi ya hayo, kiwango chake cha kuyeyuka ni −164 °C ilhali kiwango cha kuchemka ni -152 °C, ambazo ni thamani ndogo sana ikilinganishwa na zile za oksidi nyingine za nitrojeni. Tunaweza kutoa radical hii bure kupitia uoksidishaji wa amonia ifikapo 850 °C kukiwa na kichocheo cha platinamu. Hata hivyo, kwa kipimo cha maabara, tunaweza kuitayarisha kwa kupunguza asidi ya nitriki iliyoyeyushwa na shaba.
Dinitrogen Pentoksidi ni nini?
Pentoksidi ya nitrojeni ni kiwanja isokaboni chenye fomula ya kemikali N2O5 Tunaita pentoksidi ya nitrojeni. Ni oksidi ya nitrojeni ya binary. Kwa kuongezea, haina msimamo na inaweza kufanya kama kioksidishaji hatari. Uzito wa molar wa kiwanja ni 108.01 g / mol. Inatokea rangi nyeupe thabiti.
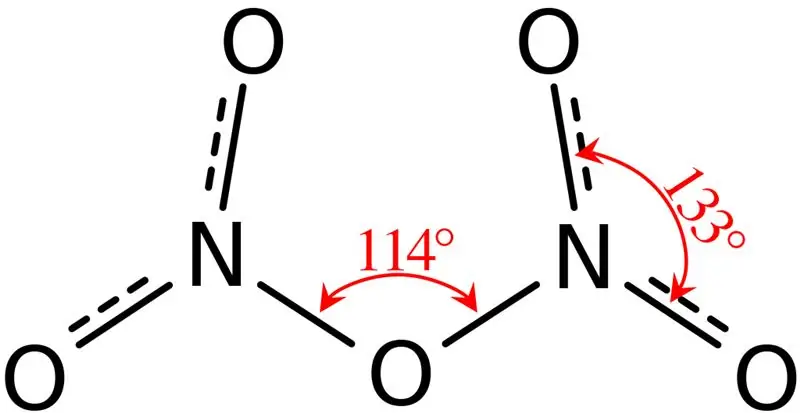
Kielelezo 02: Muundo wa Pentoksidi ya Dinitrogen
Zaidi ya hayo, kiwango myeyuko cha kiwanja hiki ni 41 °C na, ifikapo 47 °C kiwanja hiki hupitia usablimishaji. Kiwanja hiki humenyuka na maji, kutoa asidi ya nitriki. Kwa kuongeza, umbo la molekuli ya molekuli ya pentoksidi ya dinitrogen ni sayari. Tunaweza kuzalisha kiwanja hiki kupitia kupunguza maji kwa asidi ya nitriki kwa pentoksidi ya fosforasi.
Kuna tofauti gani kati ya Monoksidi ya Nitrojeni na Pentoksidi ya Dinitrogen?
Monoksidi ya naitrojeni ni kiwanja isokaboni chenye fomula ya kemikali HAPANA huku Dinitrogen pentoksidi ni kiwanja isokaboni chenye fomula ya kemikali N2O5 Tofauti kuu kati ya monoksidi ya nitrojeni na pentoksidi ya nitrojeni ni kwamba monoksidi ya nitrojeni ni gesi isiyo na rangi huku pentoksidi ya dinitrogen ni kigumu nyeupe. Zaidi ya hayo, tunaweza kutoa monoksidi ya nitrojeni kupitia oksidi ya amonia ifikapo 850 °C kukiwa na kichocheo cha platinamu. Hata hivyo, utengenezwaji wa pentoksidi ya dioksidi ni kupitia kupunguza maji kwa asidi ya nitriki na pentoksidi ya fosforasi. Wakati wa kuzingatia umbo la molekuli, monoksidi ya nitrojeni ni ya mstari huku pentoksidi ya dinitrogen ikiwa sayari.
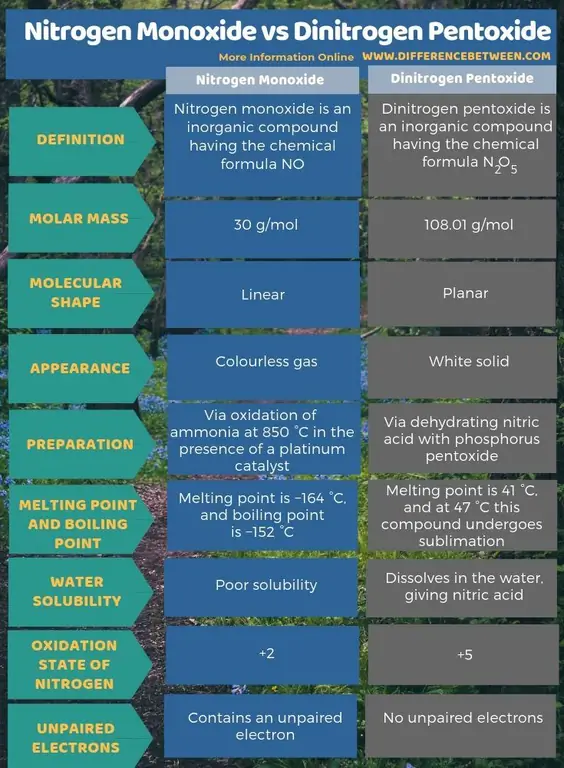
Muhtasari - Monoksidi ya Nitrojeni dhidi ya Pentoksidi ya Dinitrogen
Monoksidi ya naitrojeni ni kiwanja isokaboni chenye fomula ya kemikali HAPANA huku Dinitrogen pentoksidi ni kiwanja isokaboni chenye fomula ya kemikali N2O5 Tofauti kuu kati ya monoksidi ya nitrojeni na pentoksidi ya nitrojeni ni kwamba monoksidi ya nitrojeni ni gesi isiyo na rangi huku pentoksidi ya dioksidi ni thabiti nyeupe.






